- Das DZL
- Forschung
- DZL Academy
- Aktuelles
- Service
Internationales Forschungsteam zeigt Schlüsselmechanismen der Vernarbung bei Long-COVID und neue Verlaufsbiomarker auf.
(Aachen, Hannover, Mainz, Wuppertal, 05.Oktober 2022) Auch mehr als zwei Jahre nach Beginn der globalen COVID-19-Pandemie sind die Ursachen der als Long-COVID-Syndrom beschriebenen Langzeitfolgen einer SARS-CoV-2-Infektion noch nicht vollständig verstanden. Insbesondere die langfristigen Veränderungen des Lungengewebes nach einer schweren COVID-19-Erkrankung stellen für viele Patienten erhebliche Einschränkungen dar. Ein Teil dieser Patienten entwickelt im weiteren Verlauf eine sogenannte Post-COVID-Lungenfibrose, die durch eine rasche Vernarbung des Lungengewebes charakterisiert ist. Bislang mangelte es, zum Leidwesen vieler Betroffenen, an einem profunden Verständnis der zugrundeliegenden Mechanismen dieser Vernarbung sowie an spezifischen Blutmarkern, die diesen Vernarbungsprozess vorhersagen können. Jetzt konnte ein internationales Forschungsteam um Prof. Dr. Danny D. Jonigk, Institut für Pathologie Uniklinik RWTH Aachen und Professor für Pathologie an der Medizinischen Hochschule Hannover (MHH) sowie am DZL Standort BREATH, Hannover, PD Dr. Maximilian Ackermann vom Institut für Pathologie und Molekularpathologie des HELIOS Universitätsklinikums Wuppertal sowie vom Institut für Anatomie der Universitätsmedizin Mainz und Univ.-Prof. Dr. Dr. Detlef Schuppan, Institut für Translationale Immunologie der Universitätsmedizin Mainz, in einem ganzheitlichen Forschungsansatz den bislang unbekannten Mechanismus aufdecken, der maßgeblich zum bindegewebigen Umbau der Lunge bei schwerem COVID-19 beiträgt. Die Studie wurde nun im renommierten Fachjournal „The Lancet – eBioMedicine“ publiziert.
Unter dem Begriff der Lungenfibrosen wird eine Vielzahl verschiedener interstitieller Lungenerkrankungen zusammengefasst, bei denen eine anhaltende Entzündung zur fortschreitenden Vernarbung des Lungengerüstes führt. Obgleich man diese schwerwiegenden Erkrankungen medikamentös in ihrem Verlauf etwas verlangsamen und abschwächen kann, bleiben sie bis zum heutigen Tag nicht heilbar und weisen meist eine höhere Sterblichkeit als viele Krebserkrankungen auf. Für viele Betroffene stellt die Lungentransplantation die einzige verbleibende, lebensrettende Therapie dar. Dabei geht allen Formen der Lungenfibrose eine chronisch-entzündliche Schädigung des Lungengewebes voraus. Epidemiologische Daten von Patienten mit schweren COVID-19-Verläufen legen nahe, dass ca. 20% der hospitalisierten Patienten eine Post-COVID-Lungenfibrose entwickeln, welche in ihrem Ausmaß und Fortschreiten sehr unterschiedlich ausgeprägt ist und durch die klinische Routinebildgebung nur sehr ungenau vorhergesagt werden kann.
Um die feingeweblichen Veränderungen in diesem Vernarbungsprozess erstmals detailgenau darlegen zu können, untersuchten die Forschenden des internationalen Teams die Lungen von schwer erkrankten COVID-19-Patienten mithilfe der neuen Hierarchischen Phasen-Kontrast-Tomographie (HiP-CT), der brilliantesten Synchrotronstrahlung der Welt, an der European Synchrotron Research Facility im französischen Grenoble. Hiermit konnten sie erstmals zeigen, dass es bei schweren COVID-19-Verläufen zu einer mosaikartigen Veränderung der Lobuli, der kleinsten Lungenläppchen, und zu einer Minderversorgung des Gewebes durch Veränderungen der zuführenden Blutgefäße kommt. Im zeitlichen Verlauf der intensivstationären Behandlung zeigte sich zudem ein zunehmendes Ausmaß der Blutgefäßneubildung über einen spezifischen Mechanismus, die sog. intussuszeptive Angiogenese. Diese für COVID-19 charakteristische Blutgefäßneubildung nahm im zeitlichen Verlauf der COVID-19-Erkrankung signifikant zu und daran schloss sich ein bindegewebiger Umbau des Lungengewebes, insbesondere der Gefäße in den Läppchensepten an, ein Phänomen, welches das Team um den erfahrenen Thoraxpathologen Prof. Jonigk ebenfalls schon in anderen Formen der Lungenfibrose beobachten konnte. „Die Blutgefäßneubildung stellt in vielen Formen von interstitiellen Lungenerkrankungen ein Charakteristikum des Fortschreitens der Fibrose dar. Gerade die vielen neugebildeten Blutgefäße, die z. B. über die intussuszeptive Angiogenese entstehen können, versorgen zwar kurzfristig das Gewebe mit mehr Sauerstoff, aber auch mit Entzündungszellen, die den Prozess umso mehr verstärken“, resümiert Jonigk die Mechanismen, die zur Zunahme der Vernarbungsprozesse beitragen. „Diese heterogen verteilten distinkten Veränderungen auf Ebene der feinsten Lungenlobuli lassen sich über die klinische Bildgebung aufgrund der fehlenden Detailschärfe gar nicht erkennen. Somit konnten wir mit der neuen Technologie des HiP-CT erstmals zeigen, dass die Vernarbungsprozesse bei Post-COVID-Fibrosen das Resultat eines generalisieren Gefäßschadens durch das SARS-CoV-2-Virus sind."
Die Forschenden des Projektes haben zusätzlich Gewebeproben mithilfe der Nanostring- und MALDI-TOF-Technologie analysiert. Diese innovativen Hochdurchsatzverfahren ermöglichen es, molekulare Marker auf Basis von Proteomik- und Metabolomikdaten zu identifizieren, um somit sprichwörtlich die „Nadel im Heuhaufen“ zu finden. Der erstmalige Einsatz beider Technologien bei schweren COVID-19-Verläufen erlaubte es den Forschenden, neue Gewebemarker des schweren COVID-19 Verlaufs zu identifizieren. „Für die klinische Verschlechterung betroffener Patienten im zeitlichen Verlauf der COVID-19-Erkrankung sehen wir insbesondere eine signifikante Zunahme von Entzündungsmarkern und Markern der Blutgefäßneubildung verantwortlich“, fasst Dr. Jan-Christopher Kamp aus der Hannoveraner Arbeitsgruppe für Lungenforschung die umfangreichen molekularen Daten zusammen. „Dabei ist gerade die Korrelation der molekularen Daten mit dem morphologischen Schädigungsmuster entscheidend.“ Hierfür hat das Forscherteam erstmalig Gewebe von an schweren COVID-19-Erkrankungen verstorbenen Patienten „morpho-molekular“ mit Gewebeproben der häufigsten interstitiellen Lungenerkrankungen verglichen. Dabei konnten sie teilweise Überschneidungen zu den gängigen Schädigungsmustern der Lungenfibrose, wie z.B. dem sog. „NSIP- und UIP-Muster“ feststellen, jedoch bot COVID-19 den Wissenschaftlerinnen und Wissenschaftlern auch spezifische molekulare Muster dar, die spezifisch für die schwere COVID-19-Erkrankung waren. „Unser Ziel war es, Licht ins Dunkel der schweren COVID-19-Verläufe zu bringen, die gerade die Entstehung einer Lungenfibrose begünstigen bzw. verursachen. Auch wenn die Folgen von Long-COVID einen breiten öffentlichen Diskurs finden, so sehen wir ein eindeutiges vernarbendes Schädigungsmuster bei Long-COVID, welches viele Parallelitäten zu schweren interstitiellen Lungenerkrankungen aufweist“, ergänzt Ackermann die Ausführungen seiner Kollegen aus Aachen und Hannover.
Dabei war es dem internationalen Forschungsteam besonders wichtig, nicht nur Gewebemarker der schweren COVID-19-Erkrankung zu untersuchen, sondern diese auch im Blutserum von Patientinnen und Patienten mit leichten und schweren COVID-19-Verläufen zu messen. Hierbei konnten sie u.a. drei „Schlüsselbiomarker“ identifizieren, die man als "matrizelluläre Biomarker" zusammenfassen kann. Diese matrizellulären Proteine sind frühe Stellschrauben, die den fortschreitenden Fibrosierungsprozess des Lungengewebes starten, wenn er noch umkehrbar und somit therapierbar ist. Auch bei Patienten mit schweren Lungenfibrosen, wie der sog. Idiopathischen Lungenfibrose (IPF) als auch Patienten mit akutem Lungenversagen (ARDS) fanden die Wissenschaftlerinnen und Wissenschaftler signifikant höhere Werte, die über die medikamentöse Therapie etwas reduziert werden konnten. „Für uns bot der erstmalige umfangreiche Vergleich von Blut- und Gewebe-Biomarkern bei COVID-19- und IPF-Patienten die Möglichkeit, frühe Merkmale der Entstehung von Lungenfibrosen im Blut aufzudecken", fasst Univ.-Prof. Dr. Dr. Detlef Schuppan von der Universitätsmedizin Mainz und der Harvard Medical School die umfangreichen Ergebnisse der Studie zusammen. „Klinischerseits fehlen uns schon lange verlässliche prädiktive Blutmarker, die uns helfen, Lungenfibrose-Patienten zu identifizieren und das Fortschreiten der Fibrose vorauszusagen. Diese sog. ‚prädiktiven Serum-Biomarker‘ ermöglichen es uns, neue Therapieansätze zu finden und die Therapie für die betroffenen Patienten und Patientinnen frühestmöglich zu starten, wenn die Vernarbungsprozesse noch über eine medikamentöse Therapie umkehrbar sind und auch den Erfolg verschiedener Therapien frühzeitig vorauszusagen“, resümiert Schuppan den großen Nutzen der neuen matrizellulären Biomarker für Patienten mit Long-COVID oder einer Lungenfibrose.
Die Arbeit ist Teil eines internationalen Forschungsnetzwerks von Aachen, Antwerpen, Basel, Boston, Grenoble, Heidelberg, Kopenhagen, Mainz, Port St. Lucie, München und Wuppertal und wurde durch renommierte Forschungseinrichtungen unterstützt, so u. a. durch den Europäischen Forschungsrat (ERC), das US-amerikanische NIH, die deutsche DFG, die Chan Zuckerberg Initiative CZI und den britischen Wellcome Trust.
Abbildung 1. Verschiedene Segmentierungen von via Synchrotron-basierter hierarchischer Phasenkontrast-Tomographie (HiP-CT) generierten Abbildungen der Lunge eines an schwerem COVID-19 verstorbenen Patienten. Die HiP-CT-Technologie erlaubt verschiedenste Betrachtungsarten des Organs von der makroskopischen Ebene (A) bis zur Einzelzelle. Je nach Segmentierung können verschiedenste Strukturen, wie z. B. die Kapillargefäße, welche die Lungenarterien und die Bronchien umgeben (B), spezifisch dargestellt werden. Verschiedene Zustände des Gewebes, wie z. B. luftgefüllte, besonders stark durchblutete oder narbig umgebaute Areale können farblich codiert werden (C), was verschiedene räumlich auflösende Analysen erlaubt. Die Dichtigkeit des Lungengewebes kann anhand verschiedener Grauwerte dargestellt werden, wodurch sich hier z. B. das mosaikartige Schädigungsmuster nachvollziehen lässt. Die landkartenartige Darstellung verschiedener Dichteareale (E) sowie die Segmentierung der Lungenläppchen (F) verdeutlicht die direkte Nachbarschaft von hochgradig veränderten (blau/rot) und nahezu gesund erscheinenden (gelb/violett) Lungenläppchen.
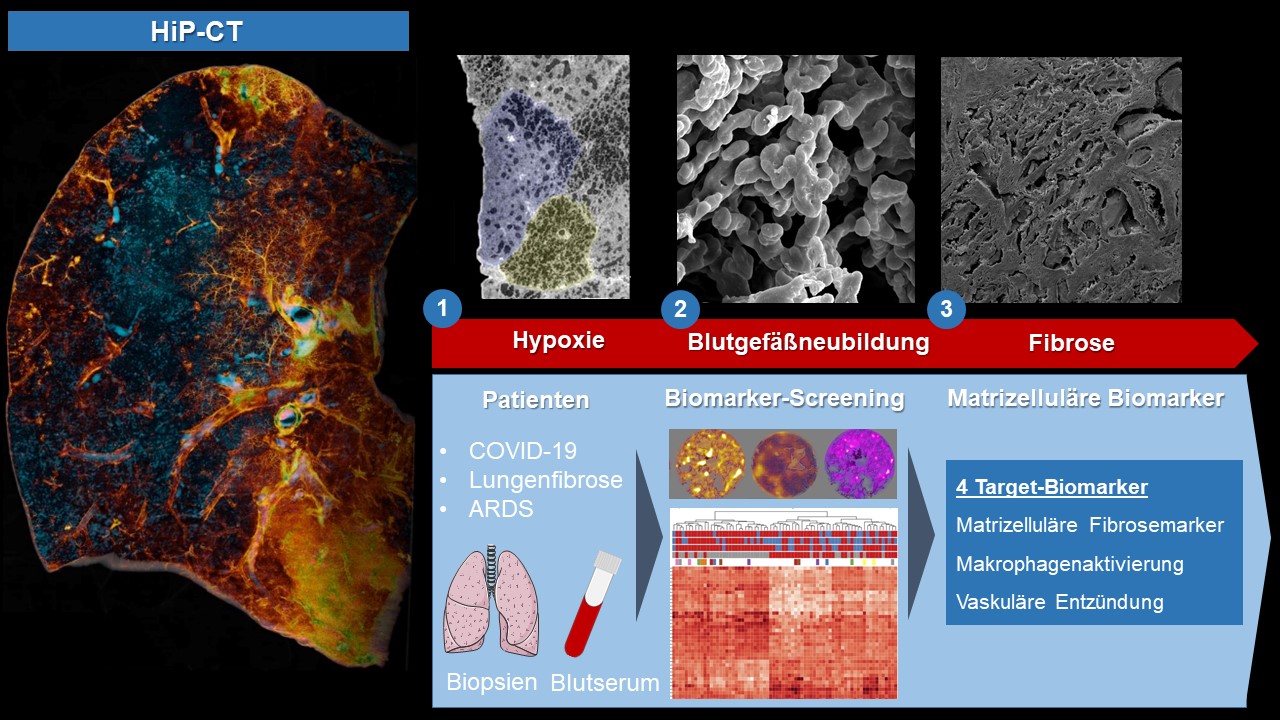
Abbildung. Mithilfe der Synchrotron-basierten hierarchischen Phasenkontrast-Tomographie (HiP-CT) konnte erstmalig gezeigt werden, dass es bei schweren COVID-19-Verläufen zu einer mosaikartigen hypoxischen Minderversorgung der kleinsten funktionellen Einheit der Lunge, den Lungenlobuli, kommt. Über diese Hypoxie und Gefäßschädigung durch das SARS-CoV-2 Virus kommt es zu einer exzessiven Blutgefäßneubildung, der sog. intussuszeptiven Angiogenese, welche in kürzester Zeit über Entzündungsvorgänge zu einer Vernarbung und Fibrosierung des Lungengewebes führt. Um mögliche therapeutische Angriffspunkte bzw. Verlaufsbiomarker zu identifizieren, wurde Blutserum und Biopsiegewebe von Patienten mit verschiedenen COVID-19-Verläufen, Lungenfibrosen (IPF) und akuter Lungenschädigung (ARDS) in einem breiten Screeningansatz auf Proteomik- und Metabolomik-Ebene analysiert und validiert. Hierbei konnten vier matrizelluläre Biomarker (CD163, IGFBP7, Thrombospondin 2 und GDF15) als prädiktive Biomarker identifiziert werden, die das Fortschreiten des Vernarbungsprozesses begünstigen. Bildquelle: Paul Tafforeau, ESRF; Claire Walsh, UCL; Maximilian Ackermann, Universitätsmedizin Mainz
Ackermann M*, Kamp JC*, Werlein C, Walsh CL, Stark H, Prade V, Surabattula R, Wagner WL, Disney C, Bodey AJ, Illig T, Leeming DJ, Karsdal MA, Tzankov A, Boor P, Kuehnel MP, Laenger FP, Verleden SE, Kvasnicka HM, Kreipe HH, Haverich A, Black SM, Walch A, Tafforeau P, Lee PD, Hoeper MM, Welte T, Seeliger B, David S, Schuppan D*, Mentzer SJ*, Jonigk DD*. Lobular ischemia and fibrotic remodelling drive the fatal trajectory of pulmonary COVID-19. The Lancet - eBioMedicine. Volume 85, 2022 Oct; 04 https://doi.org/10.1016/j.ebiom.2022.104296
Walsh CL, Tafforeau P, Wagner WL, Jafree DJ, Bellier A, Werlein C, Kühnel MP, Boller E, Walker-Samuel S, Robertus JL, Long DA, Jacob J, Marussi S, Brown E, Holroyd N, Jonigk DD, Ackermann M, Lee PD. Imaging intact human organs with local resolution of cellular structures using hierarchical phase-contrast tomography. Nat Methods. 2021 Dec;18(12):1532-1541. doi: 10.1038/s41592-021-01317-x.